FDA CHẤP THUẬN THUỐC MỚI ĐIỀU TRỊ ĐA U TỦY XƯƠNG KHÔNG ĐÁP ỨNG ĐIỀU TRỊ HOẶC TÁI PHÁT
Đa u tủy xương (Multiple myeloma – MM), còn được gọi là u nguyên bào tế bào plasma, là một loại ung thư của tế bào plasma, một loại tế bào bạch cầu thường tạo ra các kháng thể. Trong đa u tủy xương, tương bào tiếp tục sản xuất kháng thể như những tương bào bình thường nhưng nó lại tạo ra những kháng thể bất thường (protein M) gây tổn thương cho thận.
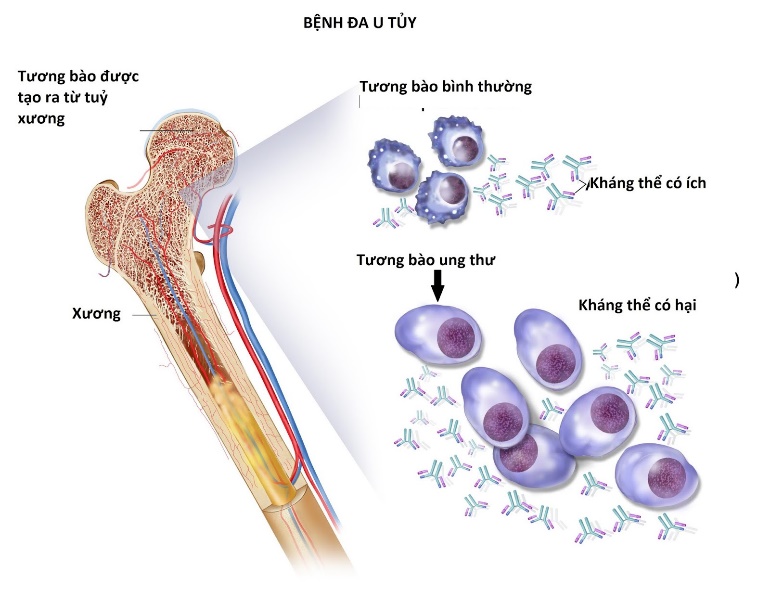
Đa u tủy xương là bệnh ung thư máu phổ biến thứ hai, ảnh hưởng đến hơn 130.000 bệnh nhân ở Mỹ; khoảng 32.000 người Mỹ được chẩn đoán mắc bệnh đa u tủy xương mỗi năm.
Ngày 2/3/2020, Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) vừa phê duyệt Sarclisa® (isatuximab-irfc) kết hợp với pomalidomide (Pomalyst , Celgene) và dexamethasone để điều trị bệnh đa u tủy xương không đáp ứng điều trị hoặc tái phát (relapsed refractory multiple myeloma-RRMM) ở người trưởng thành, những trường hợp đã nhận được ít nhất hai liệu pháp trước đó bao gồm lenalidomide và chất ức chế proteasome.
Isatuximab là một kháng thể đơn dòng chống CD38 được tiêm truyền tĩnh mạch (IV), hoạt động bằng cách giúp hệ thống miễn dịch tiêu diệt các tế bào ung thư tủy. CD38 là một thụ thể bề mặt có nhiều và đồng đều trên các tế bào u nguyên bào, vì vậy mà CD38 trở thành mục tiêu tiềm năng cho các phương pháp trị liệu dựa trên kháng thể như Sarclisa.
Ông Richard Pazdur, MD, Giám đốc Trung tâm ung thư của FDA kiêm Giám đốc Văn phòng bệnh ung thư tại Trung tâm đánh giá và nghiên cứu thuốc của FDA cho biết: “Mặc dù không thể chữa khỏi bệnh đa u tủy xương, nhưng hiện nay Sarclisa là một lựa chọn điều trị khác theo hướng CD38, được thêm vào danh sách các phương pháp điều trị được FDA chấp thuận cho bệnh nhân mắc bệnh đa u tủy xương tiến triển sau các liệu pháp trước đó.”
Ông nói thêm: “Trong thử nghiệm lâm sàng, ghi nhận giảm 40% nguy cơ tiến triển bệnh hoặc tử vong với liệu pháp này.”
Sự chấp thuận này dựa trên kết quả thử nghiệm không mù (open-lable) ICARIA-MM được thực hiện ngẫu nhiên qua thử nghiệm lâm sàng pha 3 của isatuximab trên 307 bệnh nhân.
Với thời gian theo dõi trung bình là 11,6 tháng, thì thời gian sống sót không tiến triển trung bình ở nhóm bệnh nhân dùng isatuximab-pomalidomide-dexamethasone là 11,5 tháng so với nhóm dùng pomalidomide-dexamethasone là 6,5 tháng (tỷ lệ rủi ro là 0,60; P= 0.001) theo kết quả báo cáo năm ngoái. Tỷ lệ đáp ứng tổng thể là 60,4% cho nhóm điều trị 3 thuốc và 35,3% cho nhóm điều trị 2 thuốc.
Các tác dụng phụ phổ biến nhất của isatuximab (xảy ra ít nhất 20% bệnh nhân) bao gồm giảm bạch cầu (96%), phản ứng liên quan đến tiêm truyền (39%), viêm phổi (31%), nhiễm trùng đường hô hấp trên (57%), tiêu chảy (26%), thiếu máu, giảm bạch cầu lympho, giảm tiểu cầu.
Trường hợp tử vong vì các tác dụng phụ liên quan đến điều trị đã được báo cáo cho một bệnh nhân (< 1%) trong nhóm isatuximab-pomalidomide-dexamethasone (nhiễm trùng huyết) và hai bệnh nhân (1%) trong nhóm pomalidomide- dexamethasone (viêm phổi và nhiễm trùng đường tiết niệu).
Thuốc cũng có thể gây ra các tác dụng phụ nghiêm trọng, bao gồm các phản ứng liên quan đến truyền tĩnh mạch (IV). Khi xảy ra một phản ứng bất lợi cấp độ 3 hoặc cao hơn, cần ngưng sử dụng Sarclisa vĩnh viễn và thiết lập sự quản lý y tế thích hợp.
FDA ghi nhận tỷ lệ mắc các khối u ác tính nguyên phát thứ hai cao hơn với bệnh nhân đa u tủy tiếp nhận Sarclisa, được quan sát trong một thử nghiệm lâm sàng có kiểm soát.
FDA cũng nhấn mạnh rằng isatuximab có thể gây trở ngại cho các thử nghiệm trong phòng thí nghiệm và cần thông báo cho các ngân hàng máu khi bệnh nhân đang tiếp nhận điều trị isatuximab. Ví dụ, Isatuximab có thể gây trở ngại cho việc sàng lọc kháng thể đối với bệnh nhân cần truyền máu. Isatuximab cũng có thể gây trở ngại cho các xét nghiệm theo dõi protein M, ảnh hưởng đến việc xác định đáp ứng một cách đầy đủ.
Người dịch:
Trần Ngân Thi – SVD3A Trường Đại học Y Dược Huế
Hiệu đính:
Võ Thị Quỳnh Nhi – SVD5A Trường Đại học Y Dược Huế
Thái Thị Thu Hiền – SVD4A Trường Đại học Y Dược Huế
Nguồn:
[1] FDA Approves New Drug for Relapsed/Refractory Multiple Myeloma. https://www.medscape.com/viewarticle/926069
[2] FDA approves Sarclisa® (isatuximab-irfc) for patients with relapsed refractory multiple myeloma.
https://www.sanofi.com/en/media-room/press-releases/2020/2020-03-02-19-51-16
[3] Đa u tủy xương có phải ung thư. Báo sức khỏe và đời sống – Cơ quan ngôn luận của Bộ Y Tế.
https://suckhoedoisong.vn/da-u-tuy-xuong-co-phai-ung-thu-n101210.html